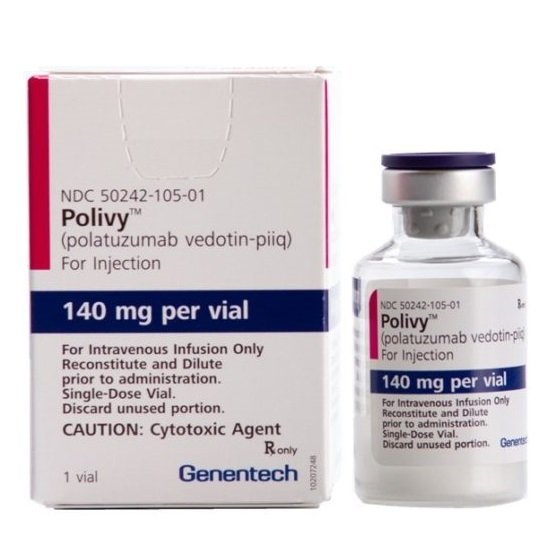
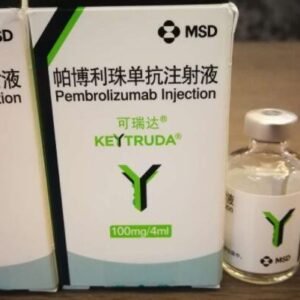
حقن بولاتوزوماب فيدوتين
فيبوتوزوماب للحقن
الطب الغربي، الطب الوصفي، التأمين غير الطبي، الدواء الأصلي
تأثيرات:
يستخدم هذا المنتج بشكل أساسي لعلاج المرضى البالغين الذين يعانون من سرطان الغدد الليمفاوية ذات الخلايا البائية الكبيرة المنتشرة غير المعالجة سابقًا (DLBCL)؛ وللمرضى البالغين الذين يعانون من سرطان الغدد الليمفاوية ذات الخلايا البائية الكبيرة المنتكسة أو المقاومة للعلاج والذين لا يناسبهم زرع الخلايا الجذعية المكونة للدم.
الاستخدام والجرعة:
الجرعة الموصى بها من هذا المنتج للمرضى الذين يعانون من سرطان الغدد الليمفاوية في الخلايا البائية الكبيرة المنتشرة غير المعالجة سابقًا هي 1.8 ملغم / كغم، ويتم إعطاؤه عن طريق التسريب في الوريد مرة واحدة كل 21 يومًا (دورة واحدة) بالاشتراك مع ريتوكسيماب وسيكلوفوسفاميد ودوكسوروبيسين وبريدنيزون (R-). CHP) لمدة 6 دورات في اليوم الأول من كل دورة، يتم إعطاء بريدنيزون أولاً، ومن ثم يمكن إعطاء هذا المنتج، ريتوكسيماب، سيكلوفوسفاميد ودوكسوروبيسين بأي ترتيب في الأيام من 1 إلى 5 من كل دورة يتم إجراؤه في الدورتين 7 و 8. الجرعة الموصى بها من هذا المنتج للمرضى الذين يعانون من سرطان الغدد الليمفاوية في الخلايا البائية الكبيرة المنتكسة أو المقاومة للعلاج هي 1.8 ملغم / كغم، ويتم إعطاؤه عن طريق التسريب في الوريد مرة واحدة كل 21 يومًا (دورة واحدة) ويتم إعطاؤه في الدورة بالاشتراك مع بينداموستين وريتوكسيماب لمدة 6 دورات، في اليوم الأول من كل دورة، يمكن ضخ هذا المنتج، بينداموستين وريتوكسيماب بأي ترتيب. يعطى للمرضى قبل 30 دقيقة على الأقل من تسريب هذا المنتج. يتم إعطاء الجرعة الأولى من فيبوتوزوماب بعد 90 دقيقة من التسريب في الوريد. يجب مراقبة المرضى من أجل التفاعلات المرتبطة بالتسريب أثناء التسريب ولمدة 90 دقيقة على الأقل بعد الانتهاء الجرعة الأولى إذا تم تحمل المنتج جيدًا أثناء التسريب السابق، فيمكن استخدام التسريب لمدة 30 دقيقة للإعطاء اللاحق، ويجب مراقبة المريض أثناء التسريب ولمدة 30 دقيقة على الأقل بعد الانتهاء من التسريب.
ردود الفعل السلبية:
تشمل التفاعلات الضارة التي قد تحدث بعد تناول الدواء الاعتلال العصبي المحيطي، وتثبيط نخاع العظم، والعدوى، واعتلال بيضاء الدماغ متعدد البؤر التقدمي، والتسمم الكبدي، وما إلى ذلك. في التجربة السريرية المحورية GO39942 (POLARIX)، مرضى DLBCL غير المعالجين سابقًا والذين تلقوا فيبوتوزوماب مع R-CHP (ن = 435) أو R-CHOP (العدد = 438) تم الإبلاغ عن التفاعلات الدوائية الضارة (ADRs) التي حدثت أثناء العلاج والمتابعة، التفاعلات الدوائية الضارة الأكثر شيوعًا (≥30٪) (جميع الدرجات) في المرضى الذين عولجوا بـ vepotuzumab مع R-. كان CHP هو الاعتلال العصبي المحيطي (52.9٪)، والغثيان (41.6٪)، وقلة العدلات (38.4٪)، والإسهال (30.8٪). وكانت التفاعلات الجانبية الخطيرة الأكثر شيوعًا التي تم الإبلاغ عنها في ≥5٪ من المرضى هي قلة العدلات الحموية (10.6٪) والمعدية. الالتهاب الرئوي (5.3٪). بين المرضى الذين عولجوا بـ vepotuzumab بالإضافة إلى R-CHP، حدث تفاعل دوائي يؤدي إلى وقف العلاج في ≥1٪ من المرضى: الالتهاب الرئوي (1.1٪) تم تقييم سلامة vepotuzumab في 151 مريضًا في دراسة GO29365. كانت التفاعلات الدوائية الأكثر شيوعًا (≥30%) (جميع الدرجات) في المرضى الذين عولجوا بفيبوتزوماب بالإضافة إلى BR هي قلة العدلات (45.7%)، والإسهال (35.8%)، والغثيان (33.1%)، وقلة الصفيحات (32.5%)، وفقر الدم (31.8%). ) ، والاعتلال العصبي المحيطي (30.5٪) تم الإبلاغ عن ردود فعل سلبية خطيرة في 41.7٪ من المرضى الذين عولجوا بـ vepotuzumab بالإضافة إلى BR. وكانت التفاعلات الجانبية الخطيرة الأكثر شيوعًا التي تم الإبلاغ عنها في ≥5٪ من المرضى هي: قلة العدلات الحموية (10.6٪) والإنتان (10.6٪). 9.9٪)، والالتهاب الرئوي (8.6٪)، والحمى (7.9٪) بين المرضى الذين عولجوا باستخدام فيبوتوزوماب مع BR، كان التفاعل العكسي للدواء الذي أدى إلى وقف العلاج في أكثر من 5٪ من المرضى هو نقص الصفيحات (7.9٪).
موانع المخدرات:
يمنع استخدامه في حالات الحساسية تجاه هذا المنتج. يستخدم بحذر أثناء الحمل. يستخدم بحذر في بداية الحمل. يستخدم بحذر في أواخر الحمل. يستخدم بحذر أثناء الرضاعة.