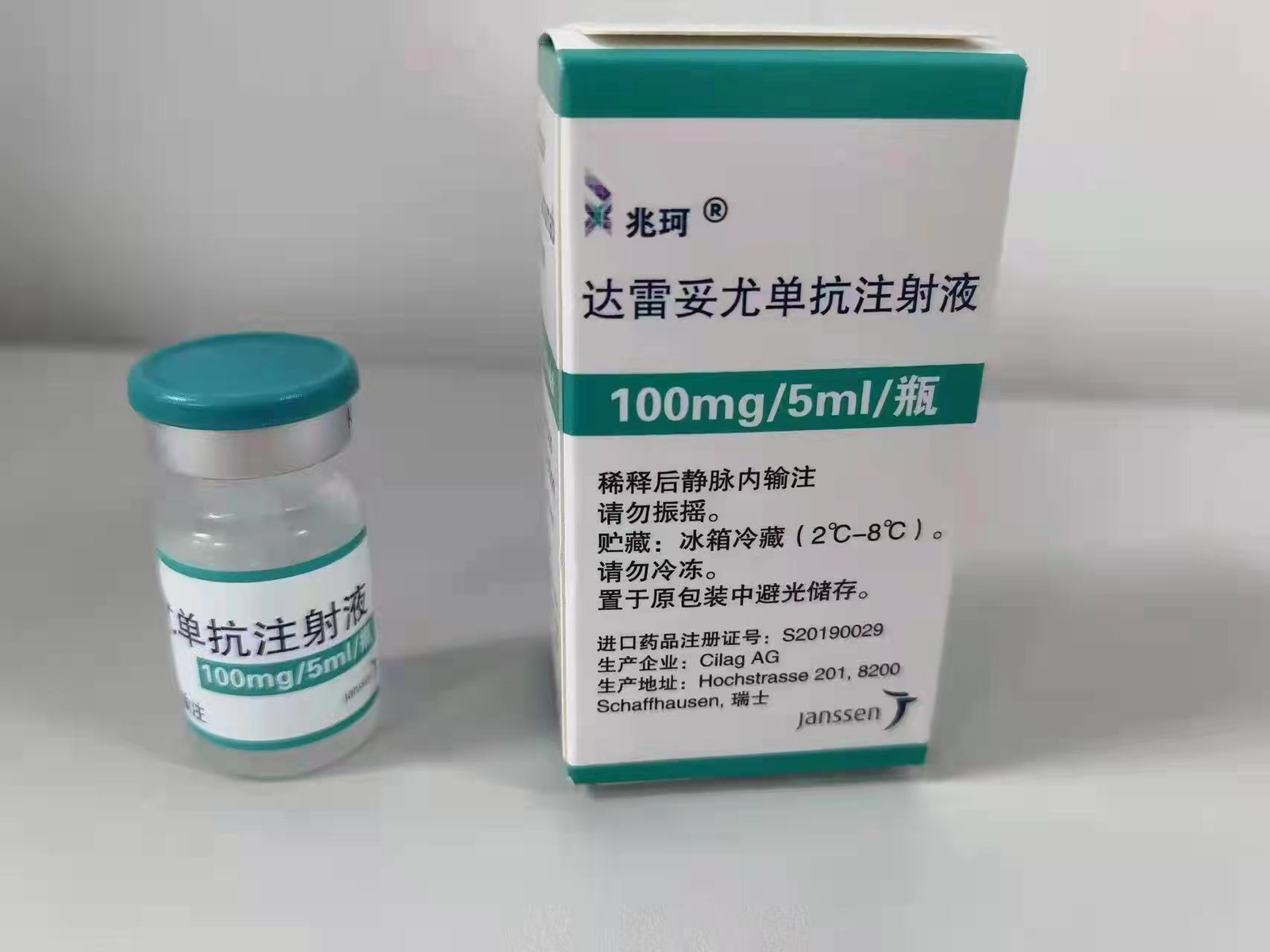
حقن داراتوموماب (الحقن تحت الجلد)
وظيفة ومؤشر:
[المؤشرات] هذا المنتج مناسب لـ: (1) الدمج مع الليناليدوميد والديكساميثازون أو البورتيزوميب والملفان والبريدنيزون لعلاج المرضى البالغين الذين تم تشخيصهم حديثًا والذين يعانون من المايلوما المتعددة والذين لا يناسبهم زرع الخلايا الجذعية الذاتية. (2) المشاركة مع ليناليدوميد وديكساميثازون أو بورتيزوميب وديكساميثازون لعلاج المرضى البالغين المصابين بالورم النقوي المتعدد والذين تلقوا خطًا واحدًا من العلاج على الأقل. (3) العلاج الأحادي للمرضى البالغين المصابين بالورم النقوي المتعدد الانتكاسي والمقاوم والذين تلقوا علاجًا سابقًا بما في ذلك مثبطات البروتيزوم ومعدلات المناعة ويتطور لديهم المرض في وقت العلاج الأخير.
الجرعة والإدارة: يجب أن يتم إعطاء هذا المنتج من قبل العاملين الطبيين في ظروف مجهزة بمرافق الإنعاش. الاستخدام: يجب إعطاء الأدوية قبل وبعد التسريب لتقليل خطر التفاعلات المرتبطة بالتسريب (IRR) لهذا المنتج. انظر “الأدوية المصاحبة الموصى بها” و”إدارة التفاعلات المرتبطة بالتسريب” و[الاحتياطات] أدناه. نظام الجرعات القياسي للعلاج المركب مع الليناليدوميد (نظام جرعات لمدة 4 أسابيع) والعلاج الأحادي: الجرعة الموصى بها من هذا المنتج هي 16 مجم / كجم، بالتسريب في الوريد، ويظهر جدول الجرعات في الجدول 1. الجدول 1: نظام الجرعات القياسي للعلاج المركب مع الليناليدوميد (نظام جرعات لمدة 4 أسابيع) والعلاج الأحادي نظام الجرعات الأسبوع 1-8 مرة واحدة في الأسبوع (8 جرعات إجمالاً) الأسبوع 9-24 أ مرة كل أسبوعين (8 جرعات إجمالاً) من الأسبوع 25 حتى تطور المرض مرة كل 4 أسابيع أ الجرعة الأولى من نظام الجرعات مرة كل أسبوعين تكون في الأسبوع 9. ب الجرعة الأولى من نظام الجرعات مرة كل 4 أسابيع تكون في الأسبوع 25. للتعرف على جرعات وجدول جرعات الأدوية المستخدمة مع هذا المنتج، راجع [التجارب السريرية]. نظام الجرعات للعلاج المركب مع بورتيزوميب والملفان والبريدنيزون (نظام جرعات لمدة 6 أسابيع): الجرعة الموصى بها من هذا المنتج هي 16 ملغم / كغم، بالتسريب في الوريد، ويظهر جدول الجرعات في الجدول 2. الجدول 2: نظام الجرعات لـ العلاج المركب لهذا المنتج مع بورتيزوميب والملفان والبريدنيزون (VMP) (نظام الجرعات لدورة مدتها 6 أسابيع) نظام الجرعات الأسبوعي أسابيع 1-6 مرة واحدة في الأسبوع (إجمالي 6 جرعات) الأسابيع 7-54 أ مرة واحدة كل 3 أسابيع ( إجمالي 16 جرعة) من الأسبوع 55 حتى تطور المرض ب مرة واحدة كل 4 أسابيع أ الجرعة الأولى من نظام مرة كل 3 أسابيع هي الأسبوع 7 ب الجرعة الأولى من نظام مرة كل 4 أسابيع هي الأسبوع 55 يتم إعطاء بورتيزوميب مرتين في الأسبوع خلال أسابيع 1 و 2 و 4 و 5 من الدورة الأولى التي تبلغ مدتها 6 أسابيع، ومرة واحدة في الأسبوع في الأسابيع 1 و 2 و 4 و 5 من الدورات الثمانية التالية التي تبلغ مدتها 6 أسابيع. لمعرفة الجرعة ونظام جرعات الأدوية المستخدمة مع هذا المنتج، راجع [التجارب السريرية]. نظام الجرعات للعلاج المركب مع بورتيزوميب (نظام الجرعات لدورة مدتها 3 أسابيع): الجرعة الموصى بها من هذا المنتج هي 16 ملغم / كغم. التسريب في الوريد، ويظهر جدول الجرعات في الجدول 3. الجدول 3: نظام الجرعات للعلاج المركب مع بورتيزوميب (نظام الجرعات لمدة 3 أسابيع) نظام الجرعات الأسبوعي الأسابيع 1-9 مرة واحدة في الأسبوع (9 جرعات في المجموع) الأسابيع 10-24أ مرة كل 3 أسابيع (5 جرعات إجمالاً) من الأسبوع 25 حتى تطور المرض ب مرة كل 4 أسابيع أ الجرعة الأولى من نظام مرة كل 3 أسابيع في الأسبوع 10 ب الجرعة الأولى من نظام مرة كل 4 أسابيع في الأسبوع 25 الجرعة ونظام الجرعات للأدوية المستخدمة بالاشتراك مع بورتيزوميب، انظر [التجارب السريرية]. معدل التسريب: بعد التخفيف، يجب تسريب البورتيزوميب عن طريق الوريد بمعدل التسريب الأولي الموضح في الجدول 4 أدناه. لا ينبغي النظر في زيادة معدل التسريب إلا في حالة عدم وجود تفاعلات مرتبطة بالتسريب. لسهولة الإعطاء، يمكن تقسيم الجرعة الأولى من الدواء في الأسبوع الأول (الجرعة 16 مجم/كجم) إلى يومين متتاليين، أي 8 مجم/كجم في اليومين 1 و2، انظر الجدول 4 أدناه. الجدول 4: معدلات التسريب لإدارة الإندول (16 مجم / كجم) المعدل الأولي لحجم التخفيف (الساعة الأولى) معدل الزيادة الحد الأقصى لمعدل الأسبوع 1 نظام التسريب 1 (تسريب فردي) الأسبوع 1 اليوم 1 (16 مجم / كجم) 1000 مل 50 مل / ساعة 50 مل / ساعة، 200 مل / ساعة في الساعة النظام 2 (تسريب الأجزاء) الأسبوع 1 اليوم الأول (8 مجم / كجم) 500 مل 50 مل / ساعة 50 مل / ساعة، 200 مل / ساعة في الساعة الأسبوع 1 اليوم 2 (8 مجم / كجم) 500 مل 50 مل / ساعة 50 مل / ساعة، 200 مل / ساعة في الساعة لتر / ساعة، 200 مل / ساعة في الساعة الأسبوع 2 (16 مجم / كجم) تسريب 500 مل 50 مل / ساعة 50 مل / ساعة، 200 مل / ساعة التسريب اللاحق (بدءًا من الأسبوع 3، 16 مجم / كجم) 500 مل 100 مل / ساعة 50 مل / ساعة، 200 مل / ساعة في الساعة الجدول 4: معدلات التسريب لإدارة الحقن في الوريد (16 مجم / كجم) المعدل الأولي لحجم التخفيف (الساعة الأولى) زيادة المعدل الحد الأقصى للمعدل فكر في زيادة معدل التسريب فقط في حالة عدم وجود تفاعلات مرتبطة بالتسريب (IRRs). ب استخدم حجم تخفيف قدره 500 مل فقط في حالة عدم حدوث IRR بعد تناول 16 مجم / كجم في الأسبوع السابق. خلاف ذلك، استخدم حجم التخفيف 1000 مل. ج استخدم معدلًا أوليًا معدّلًا (100 مل / ساعة) للحقن اللاحقة (أي بدءًا من الأسبوع 3) فقط في حالة عدم حدوث IRR أثناء التسريب السابق. بخلاف ذلك، استمر في إجراء عمليات الحقن اللاحقة بمعدل التسريب في الأسبوع الثاني الموضح في الجدول. إدارة التفاعلات المرتبطة بالتسريب قبل العلاج بالليفوفلوكساسين، يجب إعطاء التخدير لتقليل خطر التفاعلات المرتبطة بالتسريب (IRRs). لأي درجة / شدة من IRR، يجب إيقاف تسريب الليفوفلوكساسين على الفور ويجب إعطاء علاج الأعراض. قد يتطلب علاج الـ IRR أيضًا خفض معدل التسريب أو إيقاف الليفوفلوكساسين، كما هو موضح أدناه (انظر الاحتياطات). • الدرجة 1-2 (خفيفة إلى معتدلة): بعد أن تهدأ أعراض التفاعل المرتبط بالتسريب، فكر في إعادة بدء التسريب، ولكن يجب ألا يتجاوز المعدل نصف معدل التسريب في وقت IRR. إذا لم يعاني المريض من أي أعراض أخرى لـ IRR، فيمكن الاستمرار في زيادة معدل التسريب، مع الزيادة والفاصل الزمني اعتمادًا على الحالة السريرية، حتى معدل أقصى قدره 200 مل / ساعة (الجدول 4). • الدرجة 3 (شديدة): بعد أن تهدأ أعراض التفاعل المرتبط بالتسريب، فكر في إعادة بدء التسريب، ولكن يجب ألا يتجاوز المعدل نصف معدل التسريب في وقت IRR. إذا لم يعاني المريض من أعراض إضافية، فيمكن إعادة تشغيل معدل التسريب المتزايد، مع الزيادة والفاصل الزمني اعتمادًا على الحالة السريرية (الجدول 4). إذا تكررت أعراض الدرجة الثالثة، فيجب تكرار الخطوات المذكورة أعلاه. في حالة حدوث تفاعل ثالث متعلق بالتسريب من الدرجة 3، يجب إيقاف العلاج بهذا المنتج نهائيًا. • الدرجة الرابعة (مهددة للحياة): توقف نهائيًا عن العلاج بهذا المنتج. الجرعة المنسية إذا لم يتم حقن هذا المنتج كما هو مخطط له، وينبغي استكماله في أقرب وقت ممكن وينبغي تعديل نظام الجرعات وفقا لذلك للحفاظ على الفاصل الزمني بين الجرعات من العلاج. تعديل الجرعة: لا ينصح بتقليل جرعة هذا المنتج. في حالة حدوث تسمم دموي، قد يلزم تأخير الجرعات للسماح بتعداد خلايا الدم بالتعافي (انظر [الاحتياطات]). الأدوية المصاحبة الموصى بها دواء ما قبل التسريب أعط جميع المرضى دواء ما قبل التسريب التالي قبل 1-3 ساعات من كل حقن لهذا المنتج لتقليل خطر IRR: الكورتيكوستيرويدات (طويلة المفعول أو متوسطة المفعول) – العلاج الأحادي: التسريب الوريدي 100 ملغ ميثيل بريدنيزولون أو ما يعادله. بعد التسريب الثاني، يمكن تقليل جرعة الكورتيكوستيرويد (ميثيل بريدنيزولون 60 ملغ عن طريق الفم أو الوريد). – العلاج المركب: قم بإعطاء 20 ملغ من ديكساميثازون أو ما يعادله قبل كل تسريب لهذا المنتج. عندما يكون الديكساميثازون عبارة عن كورتيكوستيرويد موصوف كجزء من نظام الخلفية، فسيتم استخدامه كدواء ما قبل التسريب لـ VAX في يوم التسريب (انظر التجارب السريرية). ينبغي إعطاء الديكساميثازون عن طريق الوريد قبل التسريب الأول لـ VAX ويمكن النظر في تناوله عن طريق الفم قبل الحقن اللاحقة. إذا كان المرضى يتلقون الديكساميثازون كدواء مسبق، فلا ينبغي إعطاء أي كورتيكوستيرويدات إضافية موصوفة كجزء من نظام الخلفية (على سبيل المثال، بريدنيزون) في يوم ضخ VAX. • خافضات الحرارة (أسيتامينوفين 650 إلى 1000 ملغم عن طريق الفم). • مضادات الهيستامين (ديفينهيدرامين 25 إلى 50 ملغم عن طريق الفم أو الوريد أو ما يعادله). أدوية ما بعد التسريب: يجب إعطاء أدوية ما بعد التسريب التالية لتقليل مخاطر التفاعلات المتأخرة المرتبطة بالتسريب: – العلاج الأحادي: إعطاء الكورتيكوستيرويدات عن طريق الفم (20 مجم ميثيل بريدنيزولون أو ما يعادله من الكورتيكوستيرويد المتوسط أو طويل المفعول، وفقًا لما تحدده المعايير المحلية). ) يوميًا لمدة يومين بعد كل تسريب لـ VAX (يبدأ في اليوم التالي للتسريب). – العلاج المركب: فكر في إعطاء جرعة منخفضة من ميثيل بريدنيزولون عن طريق الفم (أقل من 20 مجم) أو ما يعادله في اليوم التالي لتسريب هذا المنتج. ومع ذلك، إذا تم استخدام الكورتيكوستيرويدات بموجب نظام الخلفية (على سبيل المثال، ديكساميثازون وبريدنيزون) في اليوم التالي لتسريب هذا المنتج، فقد لا تكون هناك حاجة إلى أدوية إضافية بعد التسريب (انظر [التجارب السريرية]). بالإضافة إلى ذلك، يجب أخذ أدوية ما بعد التسريب في الاعتبار، بما في ذلك موسعات الشعب الهوائية قصيرة وطويلة المفعول والكورتيكوستيرويدات المستنشقة، للمرضى الذين لديهم تاريخ من مرض الانسداد الرئوي المزمن. بعد الحقن الأربع الأولى، إذا لم يعاني المريض من IRR كبير، فيمكن إيقاف هذه الأدوية المستنشقة بعد التسريب وفقًا لتقدير الطبيب. الوقاية من إعادة تنشيط فيروس الهربس النطاقي ينبغي النظر في العلاج الوقائي المضاد للفيروسات لمنع إعادة تنشيط فيروس الهربس النطاقي. مجموعات خاصة من مرضى القصور الكلوي لم يتم إجراء دراسات رسمية لهذا المنتج على الأشخاص الذين يعانون من القصور الكلوي. بناءً على تحليل الحرائك الدوائية للسكان (PK)، لا يلزم تعديل الجرعة لدى المرضى الذين يعانون من القصور الكلوي (انظر [الحركية الدوائية]). القصور الكبدي لم يتم إجراء دراسات رسمية لهذا المنتج على الأشخاص الذين يعانون من اختلال كبدي. بناءً على تحليل PK السكاني، لا يلزم تعديل الجرعة للمرضى الذين يعانون من اختلال كبدي (انظر [الحركية الدوائية]). لا يحتاج المرضى المسنون إلى تعديل جرعتهم (انظر [استخدام كبار السن] و [حركية الدواء]). الأطفال: لا توجد بيانات بحثية سريرية حول هذا المنتج للمرضى الذين تقل أعمارهم عن 18 عامًا. الإدارة: يتم إعطاء هذا المنتج عن طريق الوريد. تمييع مع 9 ملغم / مل (0.9٪) من كلوريد الصوديوم وحقنه في الوريد. تعليمات التخفيف لهذا المنتج قبل تناوله هي كما يلي. هذا المنتج مخصص للاستخدام الفردي فقط. عند تحضير التسريب، يرجى استخدام تقنيات التعقيم التالية: • حساب الجرعة المطلوبة (ملغ) والحجم الإجمالي (مل) من محلول هذا المنتج على أساس وزن المريض، وكذلك عدد أنابيب هذا المنتج التي سيتم استخدامها. • تحقق للتأكد من أن محلول المنتج هذا عديم اللون إلى أصفر فاتح. في حالة وجود جزيئات غير شفافة، أو تغير اللون، أو جزيئات غريبة أخرى، يجب عدم استخدامه. • باستخدام تقنيات التعقيم، قم بسحب حجم معين من محلول كلوريد الصوديوم 0.9% من كيس/حاوية التسريب، ويكون الحجم المسحوب مساويًا للحجم المطلوب من محلول هذا المنتج. • ارسم الحجم المطلوب من محلول هذا المنتج وأضفه إلى كيس/وعاء التسريب الذي يحتوي على محلول كلوريد الصوديوم بنسبة 0.9% لتخفيفه إلى الحجم المناسب. يجب أن تكون حقيبة/حاوية التسريب مصنوعة من مادة البولي فينيل كلورايد (PVC)، والبولي بروبيلين (PP)، والبولي إيثيلين (PE)،أو مزيج البولي أوليفين (PP+PE). يجب إجراء التخفيف في ظل ظروف معقمة مناسبة. يجب التخلص من أي جزء غير مستخدم متبقي في الزجاجة. • اقلب كيس/وعاء التسريب بلطف لخلط المحلول. لا تهزه. قبل الاستخدام، افحص الدواء القابل للحقن بصريًا بحثًا عن الجزيئات العالقة أو تغير اللون. نظرًا لأن داراتوموماب عبارة عن بروتين، فقد ينتج المحلول المخفف جزيئات بروتينية بيضاء دقيقة جدًا وشفافة. إذا لوحظت جزيئات غير شفافة، أو تغير اللون، أو جزيئات غريبة، فلا تستخدمه. • بما أن هذا المنتج لا يحتوي على مادة حافظة، فيجب غرس المحلول المخفف المخزن في درجة حرارة الغرفة (15 درجة مئوية – 25 درجة مئوية) وفي ظروف إضاءة الغرفة خلال 15 ساعة (بما في ذلك وقت التسريب). • إذا لم يكن من الممكن استخدامه على الفور، يمكن تخزين المحلول المخفف في الظلام تحت ظروف مبردة (2 درجة مئوية – 8 درجات مئوية) لمدة لا تزيد عن 24 ساعة قبل تناوله. التجميد محظور. • ينبغي إعطاء المحلول المخفف عن طريق الوريد باستخدام مجموعة تسريب مجهزة بمنظم تدفق وفلتر معقم وغير حراري ومرتبط بالبروتين المنخفض (PES) (حجم المسام 0.22 أو 0.2 ميكرون) في الأنابيب. يجب استخدام مجموعات ضخ البولي يوريثين (PU)، أو البولي بوتادين (PBD)، أو PVC، أو PP، أو PE. • لا يجوز حقن هذا المنتج مع أدوية أخرى في نفس الخط الوريدي. • لا تقم بحفظ محلول التسريب غير المستخدم لاستخدامه لاحقًا. يجب التخلص من جميع المنتجات الدوائية أو النفايات غير المستخدمة وفقًا للمتطلبات المحلية.
ردود الفعل السلبية:
تعكس مجموعة بيانات السلامة المجمعة التعرض لداراتوموماب (16 ملغم/كغم) في 2397 شخصًا يعانون من المايلوما المتعددة، بما في ذلك 203 من علاج داراتوموماب الأحادي (العدد = 47 [دراسة MMY1003]؛ العدد = 106 [دراسة MMY2002]؛ العدد = 45 [دراسة GEN501] ]؛ ن = 5 [دراسة MMY1002]) و2,194 من العلاج المركب داراتوموماب. تعكس بيانات السلامة الموضحة أدناه تعرض المرضى (ن = 2,397) إلى 16 ملغم/كغم من تادالافيل في 13 تجربة سريرية مجمعة للتادالافيل. تشمل التفاعلات الضائرة الأكثر شيوعًا (≥20٪) قلة العدلات، وعدوى الجهاز التنفسي العلوي، والتفاعلات المرتبطة بالتسريب، ونقص الصفيحات، وفقر الدم، والإسهال، والإمساك، والاعتلال العصبي الحسي المحيطي، والسعال، والوذمة المحيطية، والغثيان، والحمى، والتعب، وضيق التنفس. التفاعلات الجانبية الخطيرة الشائعة (≥1%) هي الالتهاب الرئوي المعدي والحمى ونقص الصفيحات وقلة العدلات. قائمة التفاعلات الضارة يلخص الجدول 5 التفاعلات الجانبية لدى المرضى الذين تم علاجهم بهذا المنتج. يتم تعريف تكرار حدوثه على النحو التالي: شائع جدًا (≥1/10)، شائع (≥1/100 إلى <1/10)، عرضي (≥1/1000 إلى <1/100)، نادر (≥1/10000 إلى <1/100) <1/1000) ونادر جدًا (<1/10000). يتم ترتيب التفاعلات الضارة في كل مجموعة بترتيب تنازلي لشدتها. الجدول 5: التفاعلات العكسية لدى المرضى الذين يعانون من المايلوما المتعددة الذين تلقوا علاج داراتوموماب 16 ملغم / كغم وحيدًا أو في العلاج المركب. مجموعة بيانات السلامة الخاصة بالتفاعلات العكسية المجمعة، فئة العضو، تكرار التفاعلات الضارة (أي درجة)، حدوث أي درجة من 3-4 حالات العدوى والتهابات عدوى الجهاز التنفسي العلوي (أ) شائعة جدًا 41% 4% الالتهاب الرئوي (أ) شائعة جدًا 19% 13% التهاب الشعب الهوائية شائع جدًا 16% 2 % عدوى المسالك البولية شائعة 7% 1% الأنفلونزا شائعة 4% 1% # الإنتان شائع 4% 3% عدوى الفيروس المضخم للخلايا شائعة 1% < 1% # إعادة تنشيط فيروس التهاب الكبد الوبائي ب اضطرابات غير شائعة في الدم والجهاز اللمفاوي قلة العدلات شائعة جدًا 47% 37% نقص الصفيحات أ جدًا شائع 38% 23% فقر الدم (أ) شائع جدًا 33% 14% قلة كريات الدم البيضاء (أ) شائع جدًا 19%9% قلة اللمفاويات (أ) شائع جدًا 19%15% أمراض الجهاز المناعي نقص غاما غلوبولين الدم (أ) شائع 2%<1% # الأمراض الأيضية والغذائية فقدان الشهية شائع جدًا 11%1 % ارتفاع السكر في الدم شائع جدًا 11%3% نقص كلس الدم شائع 9%2% الجفاف شائع 2%1% # أمراض الجهاز العصبي المختلفة الاعتلال العصبي الحسي المحيطي شائع جدًا 30%3% الصداع شائع جدًا 11%<1% # تنمل شائع جدًا 10%<1 % الإغماء شائع 2%1% # مرض القلب الرجفان الأذيني شائع 3%1% مرض الأوعية الدموية ارتفاع ضغط الدم شائع جدًا 12%6% أمراض الجهاز التنفسي والصدر والمنصف السعال شائع جدًا 25%<1% # ضيق التنفس شائع جدًا 20%3% وذمة رئوية شائع 1%<1% الجهاز الهضمي